১৯৭০ সালে রিকম্বিনেন্ট ডিএনএ প্রযুক্তি আবিষ্কারের মধ্য দিয়ে জীববিজ্ঞানে নতুন যুগের সূচনা হয়। বিজ্ঞানীরা প্রথম বারের মত ডিএনএ তে পরিবর্তন নিয়ে আসার সুযোগ পান। যার ফলে একক কিংবা একগুচ্ছ জিন নিয়ে কাজ করে কিছু অভিনব ওষুধ এবং জৈবপ্রযুক্তি তৈরি হয়। সাম্প্রতিক সময়ের জিনোম এডিটিং প্রযুক্তি জীববিজ্ঞানের আরেকটি বিপ্লবের সূচনা করেছে। রিকম্বিনেন্ট ডিএনএ প্রযুক্তিতে কাংক্ষিত ডিএনএ সিকোয়েন্সকে জিনোম থেকে আলাদা করে নিয়ে কাজ করা লাগে। কিন্তু এখন একদম কোষের ভেতরে থেকেই জিনোমের মধ্যেই জিনের কাংক্ষিত পরিবর্তন ঘটানো সম্ভব। পরিবর্তন বলতে নতুন জিন যুক্ত করা, কোন জিনকে বাদ দেয়া কিংবা প্রতিস্থাপন করা সম্ভব হবে। ব্যপারটা অনেকটা ওয়ার্ড প্রসেসরের সার্চ এন্ড রিপ্লেস অপশনের মত।
তিন রকম জিনোম এডিটিং প্দ্ধতি সবচেয়ে বেশি জানা যায়।
১। ZFN
২। TALEN
৩। CRISPR/Cas9
এদের মধ্যে CRISPR/Cas9 পদ্ধতিটাই সবচেয়ে নতুন, অপেক্ষাকৃত সহজ এবং সাশ্রয়ী। বিজ্ঞানীদের মধ্যে এটা এতটাই উত্তেজনার সৃষ্টি করেছে যে একে বলা হচ্ছে ‘Biggest Biotech Discovery of the Century’। এই লেখাটি লেখার সময় পর্যন্ত সবচেয়ে সাম্প্রতিক খবর হল, এর মেধাসত্ব দাবী নিয়ে দুই দল বিজ্ঞানীর মধ্যে যুদ্ধ চলছে। বলা বাহুল্য, এই পদ্ধতির উন্নয়নে তাদের কারো অবদানই ফেলনা নয়। চলুন তাহলে তাদের স্বার্থের লড়াই চলতে চলতে আমরা এর নিঃস্বার্থ বিজ্ঞানটুকু সম্পর্কে হালকা ঝাপসা ধারনা নিয়ে নেই।

ZFN:
এর পূর্ন নাম হচ্ছে জিংক ফিঙ্গার নিউক্লিয়েজ। এটা এক ধরনের ফিউশন বা কাইমেরিক প্রোটিন। গ্রীক মিথলজিতে কাইমেরা হচ্ছে এক দানবী যার মাথা সিংহের, দেহ ছাগলের আর লেজ সরীসৃপের। কাইমেরিক প্রোটিনের ভিন্ন ভিন্ন অংশও আসে ভিন্ন ভিন্ন জিন থেকে। যাই হোক- ZFN এর একটা অংশের কাজ হল কাংক্ষিত যবক্ষারজান ঘটিত ক্ষারের ক্রম তথা নিউক্লিওটাইড সিকোয়েন্স শনাক্ত করে তাকে আকড়ে ধরা, আরেকটি অংশের কাজ হচ্ছে যায়গাটা কেটে দেয়া। আকড়ে ধরার কাজটি করে একটি প্রোটিনের চেইন। চেইনের এককগুলো হলো জিংক ফিঙ্গার প্রোটিন। এর নামে জিংক ফিঙ্গার থাকার কারন হলো এর কার্যকর আকৃতি গঠনে এক বা একাধিক জিংক আয়নের গুরুত্বপূর্ন অবদান রয়েছে। ZFN মানুষ জোড়াতালি দিয়ে তৈরি করলেও ZFP কিন্ত প্রাকৃতিক। এই গেল একটা অংশ, অপর অংশটি হচ্ছে একটি নিউক্লিয়েজ। FokI নামের এক প্রকার রেস্ট্রিকশন এনজাইম আছে, যা প্রকৃতিতে এক ধরনের ব্যাক্টেরিয়াতে পাওয়া যায়। ব্যাক্টেরিয়াতে এটা নির্দিষ্ট একটা সিকোয়েন্স পেলে কাটাকাটি করে। এর ডিএনএ বাইন্ডিং অংশটি বাদ দিয়ে শুধু কাটাকাটির অংশটি নিয়ে ZFN এ যুক্ত করা হয়েছে। একটা ZFN এ সাধারনত ৩ থেকে ৬ টা জিঙ্ক ফিঙ্গার প্রোটিন থাকে আর এরা ৯ থেকে ১৮ পর্যন্ত দৈর্ঘ্যের নিউক্লিওটাইড ক্রম শনাক্ত করতে পারে। তাহলে প্রতিটা জিংক ফিংগার প্রোটিন তিনটা করে নিউক্লিওটাইড শনাক্ত করতে পারে। তবে যেহেতু একই রকম বা কাছাকাছি সিকোয়েন্স অনেক জায়গায় থাকার সম্ভাবনা থাকে। তাই যাতে ZFN ভুল যায়গায় গিয়ে কাটাকাটি না করে তাই একটা বিশেষ কৌশল অবলম্মন করা হয়। একটা জায়গাকে টার্গেট করে দুই ধরনের ZFN তৈরি করা হয়। ডাবল স্ট্র্যান্ডের এইপাশে একটা, ওইপাশে আরেকটা বসার পর যখন এদের নিউক্লিয়েজ অংশ সংযুক্ত হয়ে ডাইমার গঠন করে তখনই কেবল কাটাকাটি করতে পারে।

TALEN:
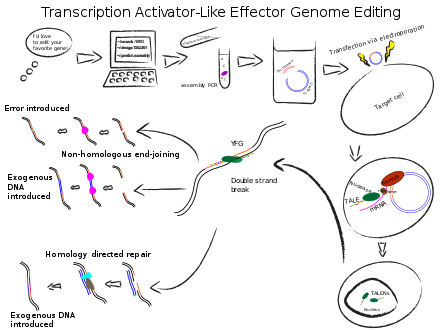
এর বিস্তারিত রূপ হচ্ছে Tanscription activator-like effector nuclease। প্রকৃতিতে TAL effector প্রোটিনটা পাওয়া যায় Xanthomonas প্রজাতির ব্যাক্টেরিয়ায়। এই ব্যাক্টেরিয়া উদ্ভিদে আক্রমন করলে আক্রান্ত উদ্ভিদকোষে এই প্রোটিন উদ্ভিদের জিনোম থেকে ব্যক্টেরিয়াকে সুবিধা দানকারী জিনগুলো খুজে বের করে সক্রিয় করে। যাই হোক, TALEN এ এর কাজ শুধু কাংক্ষিত সিকোয়েন্স খুজে বের করে সেখানে বসে পড়া। ZFN এর মত এখানেও প্রোটিনের একটা চেইন থাকে। চেইনের একেকটি একক একেকটি নাইট্রোজেন বেস শনাক্ত করতে পারে(ZFN পারে ৩টা)। তার মানে A,T,G,C চার ধরনের বেস শনাক্ত করার জন্য কমপক্ষে ৪ ধরনের TAL effector আছে। একটি TAL effector প্রোটিন ৩৪ টি এমিনো এসিড দিয়ে গঠিত। তবে এই এমিনো এসিডের শুধু ১২ এবং ১৩ তম অংশটাই বলে দেয়, এই এফেক্টর কোন বেসের সাথে যুক্ত হবে। NI নির্দেশ করে A, HD নির্দেশ করে C, NG= T এবং NK=G। অ্যাসপারাজিন, আইসোলিউসিন, হিস্টিডিন, গ্লাইসিন, অ্যাসপার্টেট এবং লাইসিন কে সংক্ষেপে যথাক্রমে N,I,H,G,D, K দিয়ে প্রকাশ করা হয়।
এর নিউক্লিয়েজ অংশটি ZFN এর মতই FokI থেকে পাওয়া। আর TALEN ও এমনভাবে তৈরি করা হয় যেন ডাইমার গঠনের পরই কাজ করতে পারে।
CRISPR/Cas9:
প্রকৃতিতে বিভিন্ন ব্যাক্টেরিয়ার জিনোমে CRISPR একটি বিশেষ জায়গার(Loci) নাম। এতে একটি নির্দিষ্ট সিকোয়েন্সের অনেকগুলো পুনরাবৃত্তি থাকে, যাদের মাঝখানে আবার বিভিন্ন ধরনের সিকোয়েন্স থাকে। CRISPR এর পুরো নাম Clustered regularly interspaced short palindromic repeat। এরা ব্যাক্টেরিয়াতে ভাইরাসের প্রতিরক্ষা হিসেবে কাজ করে। পুনরাবৃত্তিগুলোর মাঝে মাঝে যেই সিকোয়েন্স থাকে সেগুলো হল বিভিন্ন ভাইরাসের সিকোয়েন্স, এদেরকে বলা হয় স্পেসার। ভাইরাসের আক্রমনে জিনোম থেকে একটি স্পেসার(কোন ভাইরাস দ্বারা আক্রন্ত তার ভিত্তিতে) এবং একটি রিপিট আরএনএ তে ট্রান্সক্রাইব হয় এবং এর সাথে Cas9 প্রোটিন যুক্ত হয়। Cas মানে হচ্ছে CRISPR associated, এই প্রজাতির Cas1, Cas2 বিভিন্ন প্রোটিন আছে, এদের মধ্যে Cas9 এক প্রকার নিউক্লিয়েজ। যাই হোক, আরএনএ-প্রোটিন কমপ্লেক্স যখন ভাইরাসের ডিএনএ-র স্পেসার আরএনএর পরিপূরক সিকোয়েন্সের সাথে যুক্ত হয়, যাকে বলা হয় প্রোটোস্পেসার তখন Cas9 ভাইরাসের ডিএনএ কে ছিন্নভিন্ন করে দেয়। জিনোম এডিটিং এর সময়, এই স্পেসার আরএনএ অংশই টার্গেট সিকোয়েন্সের পরিপূরক আরএনএ বহন করে এবং Cas9 কে জায়গামত নিয়ে যায়। টার্গেট সিকোয়েন্সের পাশে ১০০ বেস পেয়ারের মাঝে PAM তথা Protospacer Adjacent Motif নামের একটি নির্দিষ্ট সিকোয়েন্স থাকতে হবে। CRISPR এর সাথে PAM এর সম্পর্ক এখনো সম্পুর্ন জানা যায়নি, ধারনা করা হয় CRISPR/Cas9 যেন অন্য CRISPER কমপ্লেক্স কিংবা জিনোমের CRISPR অংশের সাথে যুক্ত হয়ে কাটাকাটি শুরু না করে শুধুমাত্র টার্গেটের সাথে যুক্ত হয় তাই এই ব্যাবস্থা। কেননা, PAM সিকোয়েন্স টার্গেটে থাকলেও CRISPR Loci তে থাকেনা।
কাটলো, তারপর?
কাটার পর আসলে নিউক্লিয়েজ এর কাজ শেষ। সে টার্গেট অঞ্চল থেকে আলাদা হয়ে চলে যাবে। তখন, কোষের নিজস্ব মেকানিজম চালু হবে। নিউক্লিয়েজ গুলো যেটা করে তা হল একটা ডাবল স্ট্র্যান্ড ব্রেক তৈরি করে। ডিএনএ ডাবল স্ট্র্যান্ড, এরা জায়গামত দুটো স্ট্র্যান্ডেই কেটে দেয়। যেটা কোষের জন্য মারাত্নক ক্ষতিকর। ব্রেক এর দুই প্রান্ত যদি একেকজন একেকদিকে ভেসে চলে যায় তাহলে সব শেষ, জীবনেও আর ঠিক করা যাবেনা। এই অবস্থায় কোষের ডিএনএ মেরামতের জন্য নিযুক্ত যন্ত্রগুলো দৌড়ে চলে আসে। তারা দুই ধরনের পদ্ধতি অবলম্মন করে, HDR এবং NHEJ। যখন আপনার কোন একটা জিন যোগ করা দরকার, অথবা ক্ষতিগ্রস্থ জিন বদলানো দরকার তখন কাজ করবে HDR। এর পূর্ন নাম Homology Directed Repair। এক্ষেত্রে কোষে আপনি ZFN, TALEN কিংবা CRISPR/Cas9 এর সাথে সাথে সেই জিনের সিকোয়েন্সটাও দাতা ডিএনএ হিসেবে দিয়ে দেবেন। তখন ব্রেক এর জায়গায় মেরামতকারীরা এসে যখন দাতা ডিএনএ সিকোয়েন্সটা পেয়ে যাবে। তাকে দেখে দেখেই অনুলিপি করে আক্রান্ত জায়গাটি মেরামত করবে। যার ফলে, টার্গেট জিনটিও নতুন জিন দিয়ে প্রতিস্থাপন হবে, কিংবা সম্পুর্ন নতুন জিনটি জিনোমে যুক্ত হবে। আর যখন দরকার কোন একটি জিনকে ডিলিট করে দেয়া। তখন আর কোন হোমোলোগাস সিকোয়েন্স দেয়া লাগবেনা। NHEJ অর্থাৎ Non Homologus End Joining পদ্ধতিতে DSB এর উভয় যায়গা থেকে কিছু বেস পেয়ার ফেলে দিয়ে যায়গাটা জোড়া দিয়ে দেবে। এর ফলে টার্গেট জিনটি এমনিতেই নষ্ট হয়ে যাবে।
ভালো কোনটা?
এটার আসলে সোজাসাপ্টা উত্তর নেই। কাজের উদ্দেশ্য কি, কোন অর্গানিজম নিয়ে কাজ করছেন, কেমন সময় আপনার হাতে আছে, কেমন টাকাটুকা আছে এসব ব্যাপার বিবেচনা করে কাজের জন্য ভালো একটা পদ্ধতি নির্বাচন করতে হবে। CRISPR/Cas9 পদ্ধতিতে খরচ তুলনামূলক কম, সময়ও কম লাগে। অন্যদিকে TALEN জোড় তৈরি করতেই প্রায় ২ সপ্তাহ লেগে যায়, আবার ১০টা আলাদা ভেক্টর লাগে টুকরো অংশগুলো জোড়া দিতে। অপরদিকে CRISPR এ লাগে মাত্র ২ টা ভেক্টর। আবার জিন প্রতিস্থাপন কিংবা সন্নিবেশের ক্ষেত্রে CRISPR এর তুলনায় এখনো ZFN অথবা TALEN এর দক্ষতা বেশি। CRISPR এর এই ক্ষেত্রে ভুল জায়গায় কেরামতি করার নজির আছে। অন্যদিকে আপনি যদি একাধিক জিন নিয়ে কাজ করতে চান, তাহলে একটা CRISPR/Cas9 ই সবগুলো বহন করতে পারে। কিন্তু ZFN, TALEN এরা একের বেশি লোড নিতে পারেনা। আবার যদি ZFN আর TALEN এর মধ্যে তুলনা করতে হয়, তাহলে বলতে হবে ZFN হলো সেকালে ভ্যাকুয়াম টিউব আর TALEN একালের(!!) ট্রাঞ্জিস্টর। এর খরচ তো ওটার তুলনায় অবশ্যই কম। কিন্তু- ঝামেলা হল, TALEN বেশ বড়সর। তাই এটা কোষের মধ্যে পরিবহনটা একটু কঠিন। CRISPR/Cas যেহেতু খরচ এবং সময়ের বাধা কাটিয়ে উঠতে সক্ষম, আর যেহেতু এটা একেবারেই নতুন প্রযুক্তি। তাই ধারনা করাই যায় এর উত্তোরোত্তর উন্নতি হবে এবং শক্তভাবে নিজের অবস্থান তৈরি করে নেবে।
আমজনতার লাভ কি?
জিনোম ইঞ্জিনিয়ারিং এর হাজারটা প্রয়োগ আছে, সেগুলো টেনে এনে লেখাটাকে আর দীর্ঘায়ীত করতে চাইনা। এর পদ্ধতিগুলো আধুনিকায়নের মাধ্যমে মূল মজাটা আসলে গবেষকরাই পাবেন। আমরা আশা করতে পারি- তারা আরো দক্ষভাবে, সূক্ষভাবে কাজ করবেন। আরো দ্রুত কাজ করবেন। যেন এর সুফলগুলো আমরাও দ্রুত দেখতে পাই। আমরা আশা করতে পারি, তাদের এবং ইন্ডাস্ট্রিগুলোতে গবেষনা এবং প্রোডাকশনের। ফলে বিভিন্ন ওষুধ ও অন্যান্য বায়োটেক পন্যের দাম যেন আরো সহজলভ্য হবে। সভ্যতা এগিয়ে যাবে।
তথ্যসূত্রঃ
১। Who Owns the Biggest Biotech Discovery of the Century?
২। ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering.





Leave a Reply